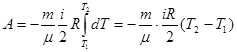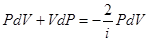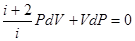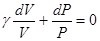§ 4.8. Внутренняя энергия идеального газа
Наиболее прост по своим свойствам одноатомный газ, т. е. газ, состоящий из отдельных атомов, а не молекул. Одноатомными являются инертные газы — гелий, неон, аргон и др. Можно получить одноатомный (атомарный) водород, кислород и т. д. Однако такие газы будут неустойчивыми, так как при столкновениях атомов образуются молекулы Н2, O2 и др.
Молекулы идеального газа не взаимодействуют друг с другом, кроме моментов непосредственного столкновения. Поэтому их средняя потенциальная энергия очень мала и вся энергия представляет собой кинетическую энергию хаотического движения молекул. Это, конечно, справедливо, если сосуд с газом покоится, т. е. газ как целое не движется (его центр масс находится в покое). В этом случае упорядоченное движение отсутствует и механическая энергия газа равна нулю. Газ обладает энергией, которую называют внутренней.
Для вычисления внутренней энергии идеального одноатомного газа массой т нужно умножить среднюю энергию одного атома, выражаемую формулой (4.5.5), на число атомов. Это число равно произведению количества вещества v = 
Умножая выражение (4.5.5) на v = 
Внутренняя энергия идеального газа прямо пропорциональна его абсолютной температуре. От объема газа она не зависит. Внутренняя энергия газа представляет собой среднюю кинетическую энергию всех его атомов.
Если центр масс газа движется со скоростью v0, то полная энергия газа равна сумме механической (кинетической) энергии 
Внутренняя энергия молекулярных газов
Внутренняя энергия одноатомного газа (4.8.1)— это по существу средняя кинетическая энергия поступательного движения молекул. В отличие от атомов молекулы, лишенные сферической симметрии, могут еще вращаться. Поэтому наряду с кинетической энергией поступательного движения молекулы обладают и кинетической энергией вращательного движения.
В классической молекулярно-кинетической теории атомы и молекулы рассматриваются как очень маленькие абсолютно твердые тела. Любое тело в классической механике характеризуется определенным числом степеней свободы f — числом независимых переменных (координат), однозначно определяющих положение тела в пространстве. Соответственно число независимых движений, которые тело может совершать, также равно f. Атом можно рассматривать как однородный шарик с числом степеней свободы f = 3 (рис. 4.16, а). Атом может совершать только поступательное движение по трем независимым взаимно перпендикулярным направлениям. Двухатомная молекула обладает осевой симметрией (рис. 4.16, б) и имеет пять степеней свободы.
Три степени свободы соответствуют ее поступательному движению и две — вращательному вокруг двух осей, перпендикулярных друг другу и оси симметрии (линии, соединяющей центры атомов в молекуле). Многоатомная молекула, подобно твердому телу произвольной формы, характеризуется шестью степенями сво§оды (рис. 4.16, в); наряду с поступательным движением молекула может совершать вращения вокруг трех взаимно перпендикулярных осей.
От числа степеней свободы молекул зависит внутренняя энергия газа. Вследствие полной беспорядочности теплового движения ни один из видов движения молекулы не имеет преимущества перед другим. На каждую степень свободы, соответствующую поступательному или вращательному движению молекул, приходится одна и та же средняя кинетическая энергия. В этом состоит теорема о равномерном распределении кинетической энергии по степеням свободы (она строго доказывается в статистической механике).
Средняя кинетическая энергия поступательного движения молекул равна 

Если эту величину умножить на число степеней свободы и число молекул газа массой m, то получится внутренняя энергия произвольного идеального газа:
Эта формула отличается от формулы (4.8.1) для одноатомного газа заменой множителя 3 на множитель f.
Внутренняя энергия идеального газа прямо пропорциональна абсолютной температуре и не зависит от объема газа.
Физика
Внутренняя энергия любого вещества — это энергия теплового движения его молекул и энергия их взаимодействия между собой. Модель идеального газа предполагает отсутствие взаимодействия между его молекулами, поэтому внутренней энергией идеального газа принято считать только энергию теплового движения молекул. Внутренняя энергия газа представляет собой сумму кинетических энергий его молекул и определяется формулой
где N — число молекул (атомов), N = ν N A ; ν — количество вещества; N A — постоянная (число) Авогадро, N A = 6,02 ⋅ 10 23 моль –1 ; 〈 E k 〉 — средняя кинетическая энергия одной молекулы, 〈 E k 〉 = i 2 k T ; i — число степеней свободы; k — постоянная Больцмана, k = 1,38 ⋅ 10 −23 Дж/К; T — абсолютная температура.
Число степеней свободы зависит от количества атомов в молекуле газа и имеет следующие значения:
- для трех- и многоатомного —
В Международной системе единиц внутренняя энергия вещества (газа) измеряется в джоулях (1 Дж).
Внутренняя энергия идеального газа определяется формулой
где i — число степеней свободы; ν — количество вещества (газа); R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К); T — абсолютная (термодинамическая) температура вещества.
Внутренняя энергия для одно-, двух-, трех- и многоатомных газов определяется следующими формулами:
- для трех- и многоатомного —
Изменение внутренней энергии газа определяется разностью
где U 1 — внутренняя энергия начального состояния газа; U 2 — внутренняя энергия конечного состояния газа.
Изменение внутренней энергии газа связано с изменением кинетической энергии движения его молекул. Изменение кинетической энергии движения молекул вещества, в свою очередь, связано с изменением температуры. Следовательно, изменение внутренней энергии газа определяется изменением его температуры.
Изменение внутренней энергии идеального газа рассчитывается по формуле
Δ U = i 2 ν R ( T 2 − T 1 ) = i 2 ν R Δ T ,
где i — число степеней свободы; ν — количество вещества; R — универсальная газовая постоянная, R ≈ 8,31 Дж/(моль ⋅ К); T 2 — абсолютная температура конечного состояния газа; T 1 — абсолютная температура начального состояния идеального газа; ∆ T = T 2 − T 1 .
Изменение внутренней энергии для одно-, двух-, трех- и многоатомных газов определяется следующими формулами:
Δ U = 3 2 ν R Δ T ;
Δ U = 5 2 ν R Δ T ;
- для трех- и многоатомного —
Изменение внутренней энергии газа Δ U при различных процессах также различно и показано в таблице (для одно-, двух-, трех- и многоатомных газов):
Одноатомный газ, i = 3
Двухатомный газ, i = 5
Трех- и многоатомный газ, i = 6
Внутренняя энергия газа не изменяется ( U = const):
- при изотермическом процессе, так как Δ T = 0;
- при циклическом процессе, так как в конце процесса газ возвращается в состояние с исходными параметрами; циклическим (круговым, замкнутым) процессом, или циклом, называется процесс, при котором газ, пройдя ряд состояний, возвращается в исходное.
Пример 1. В ходе некоторого процесса давление и объем постоянной массы идеального одноатомного газа изменяются таким образом, что pV 2 = const, где p — давление в паскалях; V — объем в кубических метрах. Во сколько раз уменьшается внутренняя энергия газа при увеличении его объема в 3 раза?
Решение . Внутренняя энергия идеального одноатомного газа определяется следующей формулой:
- для начального состояния газа —
U 1 = 3 2 ν R T 1 ,
где ν — количество вещества (газа); R — универсальная газовая постоянная, R ≈ 8,31 Дж/(моль ⋅ К); T 1 — температура газа в начальном состоянии;
- для конечного состояния газа —
U 2 = 3 2 ν R T 2 ,
где T 2 — температура газа в конечном состоянии.
Искомым является отношение
U 1 U 2 = 3 ν R T 1 2 ⋅ 2 3 ν R T 2 = T 1 T 2 .
Найдем отношение температур.
Для этого из уравнения Менделеева — Клапейрона
и подставим полученное выражение в заданный в условии задачи закон:
ν R T V ⋅ V 2 = ν R T V = const , или TV = const.
Заданное в условии соотношение между давлением и объемом эквивалентно полученному соотношению между температурой и объемом.
Для двух состояний газа справедливо тождество
T 1 V 1 = T 2 V 2 ,
где V 1 — объем газа в начальном состоянии; V 2 — объем газа в конечном состоянии.
Отсюда следует, что отношение температур определяется выражением
T 1 T 2 = V 2 V 1 ,
а искомое отношение внутренних энергий газа равно
U 1 U 2 = V 2 V 1 = 3 .
Пример 2. Термоизолированный сосуд, содержащий некоторое количество водорода, движется со скоростью 250 м/с. Как изменится температура газа, если сосуд внезапно остановить? Молярная масса водорода равна 2,0 г/моль. Теплоемкостью сосуда пренебречь.
Решение . Энергия газа в сосуде определяется суммой:
E 1 = U 1 + W k 1 ,
где U 1 — внутренняя энергия водорода (двухатомного газа) в движущемся сосуде (энергия теплового движения молекул водорода), U 1 = 5ν RT 1 /2; ν — количество водорода, ν = m / M ; m — масса водорода; M — молярная масса водорода, M = 2,0 г/моль; T 1 — начальная температура водорода; R — универсальная газовая постоянная, R = = 8,31 Дж/(моль ⋅ К); W k 1 — кинетическая энергия водорода, движущегося вместе с сосудом, W k 1 = mv 2 /2; v — скорость сосуда, v = 250 м/с;
- для остановившегося сосуда —
E 2 = U 2 + W k 2 ,
где U 2 — внутренняя энергия водорода (двухатомного газа) в остановившемся сосуде, U 2 = 5ν RT 2 /2; T 2 — конечная температура водорода; W k 2 — кинетическая энергия водорода, остановившегося вместе с сосудом, W k 2 = 0.
По условию задачи обмена энергией между газом в сосуде и окружающей средой не происходит, так как сосуд является термоизолированным; поэтому энергия газа сохраняется
или, в явном виде, —
U 1 + W k 1 = U 2 + W k 2 .
Подстановка в полученное равенство выражений для внутренней и кинетической энергий газа в сосуде дает
5 m R T 1 2 M + m v 2 2 = 5 m R T 2 2 M .
Искомая разность температур определяется формулой
Δ T = ( 250 ) 2 ⋅ 2,0 ⋅ 10 − 3 5 ⋅ 8,31 = 3,0 К.
При внезапной остановке сосуда, движущегося с указанной скоростью, температура содержащегося в нем водорода повышается на 3,0 К.
Внутренняя энергия идеального газа. Работа
Термодинамика в отличие от молекулярно-кинетической теории, изучает физические свойства макроскопических тел (термодинамических систем), не вникая в их молекулярное строение. Термодинамический метод базируется на законе сохранения и превращении энергии.
Физические величины, характеризующие термодинамическую систему, называются термодинамическими параметрами. К ним относятся: объем, давление, температура, концентрация и др. Любое изменение в термодинамической системе, связанное с изменением ее параметров, называется термодинамическим процессом, а уравнение, связывающее между собой параметры системы, называется уравнением состояния. Примером такого уравнения является уравнение Менделеева — Клапейрона (6.1)
Внутренняя энергия идеального газа
Важнейшей характеристикой термодинамической системы является ее внутренняя энергия U, складывающая из потенциальной энергии взаимодействия частиц системы и кинетической энергии их теплового движения.
Внутренняя энергия является функцией состояния системы, т.е. в каждом состоянии система обладает вполне определенным значением внутренней энергии, не зависящим от того, каким путем система перешла в это состояние.
Так как в идеальном газе потенциальная энергия молекул равна нулю (считается, что молекулы между собой не взаимодействуют), то внутренняя энергия идеального газа равна полной кинетической энергии всех его молекул. Обозначив внутреннюю энергию одного моля газа через Uμ, а среднюю кинетическую энергию молекулы через 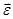
Uμ = NA 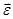
где NA – число Авогадро.
Подставляя значение 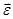
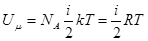
Если число молей 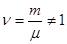
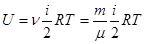
Следовательно, внутренняя энергия газа пропорциональна его массе, числу степеней свободы молекулы и абсолютной температуре газа.
Первый закон термодинамики
Внутреннюю энергию термодинамической системы можно изменить за счет работы, которую либо внешние тела совершают над ней, либо сама система совершает над внешними телами. Например, приложив внешнюю силу, мы сжимаем газ, в результате чего его температура повышается, а, следовательно, увеличивается и внутренняя энергия. Внутреннюю энергию можно изменить также, передавая системе (или отнимая у нее) некоторое количество теплоты.
Согласно закону сохранения энергии, изменение внутренней энергии системы должно равняться сумме полученной ею теплоты и совершенной над ней работы. Эта формулировка закона сохранения энергии применительно к термодинамическим системам носит название первого закона термодинамики:
Условимся считать, что теплота положительна Q>0 тогда, когда она сообщается системе, а работа положительна, когда система совершает ее над внешними телами.
В дифференциальной форме первый закон термодинамики имеет вид:
Необходимо подчеркнуть, что в отличие от внутренней энергии, являющейся функцией состояния, работа и количество теплоты зависят не только от начального и конечного состояний системы, но и от пути, по которому происходило изменение ее состояния. Следовательно, величины dQ и dА не являются полными дифференциалами, по которым может производиться интегрирование. Для того, чтобы подчеркнуть это обстоятельство для бесконечно малых приращений тепла и работы применяют более корректное обозначение 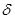
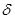
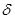
Найдем в общем виде работу, совершаемую газом, (рис.6.6, а). Если газ, расширяясь, перемещает поршень на расстояние dx, то он производит работу (см. формулу 2.19):
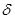
где S – площадь поршня; Sdx = dV – изменение объема газа в цилиндре.
Полная работа, совершаемая газом при изменении его объема от V1 до V2, равна:


Графически процесс изменения состояния газа при его расширении изображается участком кривой 1-2 в координатах Р – V (рис.6.6, б). Точки 1 и 2 соответствуют начальному и конечному состояниям газа. Элементарная работа PdV изображается заштрихованной площадью. Полная работа, определяемая формулой 6.23, изображается площадью V1 – 1 – 2 — V2 под кривой 1 – 2.
Теплоемкость идеальных газов.
Количество тепла, которое надо сообщить телу, чтобы изменить его температуру на 1 К, называется теплоемкостью тела С.
Согласно этому определению
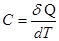
Теплоемкость единицы массы вещества называется удельной теплоемкостью Суд
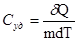
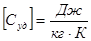
Теплоемкость одного моля называется молярной теплоемкостью См.
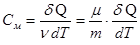
где ν = m/μ – число молей.
Как следует из формул (6.25) и (6.26), удельная теплоемкость связана с молярной соотношением:
Теплоемкость газа зависит от того, при каких условиях она определяется: при постоянном объеме или постоянном давлении. Покажем это, для чего запишем первый закон термодинамики с учетом формулы (6.22):
δQ = dU + PdV (6.28)
Если газ нагревается при постоянном объеме (изохорный процесс), то dV=0 и работа РdV = 0. В этом случае δQ = dU, т.е. передаваемое газу тепло идет только на изменение его внутренней энергии. Теплоемкость газа при постоянном объеме:
С учетом формулы (6.20)
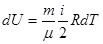
и тогда изохорная теплоемкость

Для одного моля (m/µ = 1) молярная теплоемкость при постоянном объеме
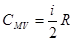
Теперь, с учетом равенства (6.28), найдем теплоемкость при постоянном давлении (изобарный процесс):

(при этом учли, что dU/dT = CV). Из (6.32) следует, что СP > CV. Это объясняется тем, что при нагревании при P = const сообщенное газу тепло идет не только на увеличение его внутренней энергии, но и на совершение работы.
Для одного моля идеального газа уравнение Менделеева – Клапейрона имеет вид PV=RT и потоку PdV=RdT. Учитывая это, получим уравнение Майера, выражающее связь между молярными теплоемкостями при постоянном давлении и постоянном объеме:
Учитывая выражение (6.31) можно записать в виде

При рассмотрении термодинамических процессов важно знать характерное для каждого газа отношение СP к СV:

Величина γ называется коэффициентом Пуассона, i – число степеней свободы молекул (см. рис.6.2).
Повышение температуры приводит, как отмечалось выше, к появлению колебательных степеней свободы, в результате чего теплоемкость возрастает. Наоборот, при низких температурах число степеней свободы уменьшается, так как «вымораживаются» вращательные степени свободы и теплоемкость газа уменьшается.
Изопроцессы
Изопроцессом называется процесс, при котором один из параметров термодинамической системы остается постоянным. Связь между параметрами системы дает уравнение Менделеева – Клапейрона.
Изотермический процесс (Т = const).
В этом случае уравнение состояния имеет вид:
Для нескольких конкретных состояний газа можно записать:
График изотермического процесса (изотерма) в координатах P – V изображается гиперболой (рис.6.7).
Подставляя 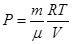

Работа изотермического процесса на рис.6.7 численно равна площади под кривой 1-2.
Из формулы 6.29 следует, что изменение внутренней энергии при dT = 0 в изотермическом процессе равно 0. Тогда первый закон термодинамики применительно к изотермическому процессу примет вид Q = A 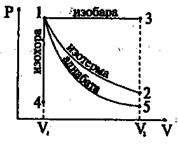
т.е. система: либо, получая тепло от внешней среды, совершает работу, расширяясь, либо отдает тепло внешней среде вследствие того, что внешние тела совершают над ней работу, сжимая ее. Следовательно, для того, чтобы при изотермическом расширении температура не падала, к газу необходимо подводить количество теплоты, эквивалентное работе расширения. Наоборот, при сжатии система должна отдавать среде количество теплоты, эквивалентное работе сжатия.
Изобарный процесс (Р = const).
Уравнение состояния при Р = const имеет вид
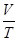
График изобарного процесса в координатах Р – V приведен на рис.6.7. Работа при изобарном процессе (см.6.23)

на графике работа при Р = const численно равна площади прямоугольника под прямой 1-3.
Первый закон термодинамики для изобарного процесса
Изохорный процесс (V = const).
При изохорном процессе уравнение состояния
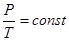
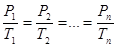
Поскольку dV = 0, то работа при изохорном процессе равна нулю. Первый закон термодинамики для изохорного процесса имеет вид
т.е. либо вся теплота, сообщаемая системе, идет на увеличение ее внутренней энергии, либо система отдает среде тепло, уменьшая свою внутреннюю энергию.
Адиабатический процесс.
Адиабатическим называется процесс, протекающий без теплообмена с внешней средой(δQ = 0). Близким к адиабатическим являются все быстропротекающие процессы, например, расширение и сжатие горючей смеси в двигателях внутреннего сгорания.
Учитывая, что δQ = 0, запишем первый закон термодинамики для адиабатического процесса:
Отсюда следует, что если газ совершает работу (адиабатически расширяясь), то А>0, соответственно ΔU 0 и ΔТ >0, т.е. газ нагревается.
Используя выражение (6.23) и учитывая, (6.20), перепишем равенство (6.41):
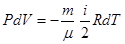
Продифференцируем уравнение Менделеева – Клапейрона (6.1):

Исключив из уравнений (6.42) и (6.43) температуру Т, получим
Разделив переменные и учитывая равенство (6.35), найдем
Интегрируя это равенство, получим
γlnV + lnP = const
Или в окончательном виде связь между давлением и объемом газа в адиабатическом процессе:
PV γ = const (6.44)
Это отношение называется уравнением адиабаты или уравнением Пуассона. Кривая адиабаты представлена на рис.6.7, которая падает с ростом объема круче, чем изотерма. Это непосредственно следует из того, что γ>1 (см. также формулу 6.35).
Уравнение Пуассона можно выразить и через другие параметры с помощью уравнения Менделеева – Клапейрона
T γ P 1-γ = const
Вычислим работу расширения газа в адиабатическом процессе. Учитывая равенство (6.42), получим